
腹腔镜贲门肌层切开术:历史回顾与现状
引言
贲门失弛缓症是一种罕见但严重的衰竭性食管疾病,其特征是食管下段括约肌(lower esophageal sphincter,LES)弛缓障碍且缺乏蠕动。在美国,这种疾病的发病率在逐渐增加,目前估计发病率约为7~10/10万人[1-3]。在询问病史时,患者可能会抱怨有进行性吞咽困难、反流、疼痛、误吸和体重减轻等症状。在许多情况下,药物治疗和内镜干预的治疗反应有限,部分患者可能会出现上述症状的反复发作。贲门肌层切开术(laparoscopic cardiomyotomy,LCM)是治疗贲门失弛缓症的有效方法,手术后约90%的患者症状得到持续改善。LCM中加做前方或后方部分胃底折叠术是当前标准的手术方式 [4,5]。
谨慎选择哪些患者能从手术干预中获益至关重要。除了详细的病史、内镜检查和静态或动态食管造影外,高分辨率食管测压和非手术治疗,可以帮助确定最适合贲门失弛缓症手术的患者。芝加哥分类标准是根据食管测压模式将贲门失弛缓症分为三类。Ⅰ型,食管无蠕动、LES松弛不完全和食管腔内无张力,食管可能是正常口径,也可能扩张,偶尔在食管造影上呈现“S”形外观,相应的食管造影显示在胃食管交界处未扩张的食管呈“鸟嘴状”畸形。Ⅱ型,食管肌肉的收缩对抗LES的不完全松弛导致的食管无蠕动和全食管扩张。在实践中,Ⅰ型和Ⅱ型之间的差异可能是短暂的,根据对食管加压的液体量,同一患者在测压研究中可能有两种类型的表现。Ⅲ型,食管造影显示有不协调的、过早的、高压收缩及LES不完全松弛。相比之下,弥漫性食管痉挛(diffuse esophageal spasm,DES)患者有不协调和过早的食管收缩,但LES的功能存在。DES的标志是吞咽时超过30%的食管保持正常的顺行蠕动。相比之下,这三种类型的贲门失弛缓症都存在食管无蠕动。最新的数据表明,90%的贲门失弛缓症患者属于Ⅰ型和Ⅱ型,通常这些患者对手术干预反应良好。有报道称LCM成功率超过95%[1,6,7]。对于扩张超过5 cm的食管或“S形”(乙状结肠型)食管,大多数外科医生推荐LCM作为一线治疗,但相当比例(20%~30%)达到这种食管病损程度的个体最终需要食管切除术[8]。
一般来说,贲门失弛缓症的治疗重点是离断LES增厚的肌层。在过去的几十年里,内镜和手术治疗贲门失弛缓症的方法都取得了进步。内镜下气囊扩张是一种首选的治疗方法,主要使食管下段肌纤维断裂及压力下降,可在部分患者中产生持久效果。其次,内镜下注射肉毒杆菌毒素可作为内科药物治疗方法,很少作为手术前的临时措施。诊断不明确的贲门失弛缓症患者对这些非手术治疗的反应,无论是通过腹腔镜还是开放手术,可能是LCM是否有效的一个预测因素。反复的内镜治疗会让患者暴露于较高的穿孔风险中,而针对年轻患者,LCM是首选的一线治疗手段[2,9-11]。
本章节将讨论贲门失弛缓症的手术方法,在文献中也称为Heller肌层切开术。从开胸手术到现在的机器人辅助手术,贲门失弛缓症的手术方法在过去三十年中进展迅速。随着这些进步,意外的细微差别、围手术期治疗方法也被本文记录和讨论。
历史回顾
吞咽困难和食管排空障碍的治疗历来以食管腔内扩张术为主。17世纪,像鲸鱼骨这样坚硬的材料被用于机械性的扩张食管。300多年后的20世纪,这种腔内扩张技术和手术方法有所发展。Ernest Heller于1913年经腹完成了第一例贲门肌层切开术[12]。Heller的原始手术是经胸完成食管下段和贲门的前方、后方的肌层切开术,而不是经腹入路的前部肌层切开术[13,14]。
直到20世纪90年代初期,气囊扩张仍然是贲门失弛缓症的首选治疗方法,手术仍然作为腔内扩张方法失败后的补救手段。1994年对贲门失迟缓症患者的一项调查表明,尽管开放手术取得了不错的效果,但四分之三的患者仍然选择球囊扩张作为主要治疗方法[15]。1991年报道了首例胸腔镜Heller食管肌层切开术[16]。随着外科医生的手术技术不断提高及患者对该技术体验,越来越多的贲门失弛缓症病例被转诊进行手术。值得注意的是,20世纪中期到20世纪90年代,在北美开胸入路很普及,而Heller描述的经腹入路在南美和欧洲被广为接受[17]。这些手术入路的偏好可能解释了对原始手术方法理解的差异,正如Pellegrini及其团队在1991年完成并报道第一例贲门失弛缓症的胸腔镜手术一样,Cuschieri及其团队在英国同样完成了第一例LCM[18]。20世纪90年代后期,基于腹腔镜胃底折叠术和对纵隔解剖的认知理解的发展,北美许多微创食管术者倾向在腹腔镜下完成该手术。值得注意的是,胸腔镜贲门肌层切开术的问题在于:(I)食管“垂直”方向的扭曲,以及难以保证需要肌层切开的解剖平面;(II)需要同时进行内镜检查以确定合适的食管肌层切开的远端长度;(III)与腹腔镜手术相比,胸腔镜术后疼痛相对更严重。此外,腹腔镜方法在技术上更简单,患者体位简单(仰卧,分腿或不分腿),而且取消了单肺通气的双腔插管,能更可靠地显示食管肌层切开的远端长度[1,4,19]。
经胸、腹入路的另一个主要区别是利用胃底折叠术来防止术后反流。在胸腔镜手术中,使用了Ellis改良的Heller肌层切开术,在贲门上5 mm处扩大切开食管肌层长度6 cm,不加做胃底折叠术[13,19]。当时,有人担心,与胸腔镜有限的胃食管游离相比,腹腔镜手术需要切开双侧膈食管韧带,实际上可能会加重反流。然而,一小样本研究中发现胸腔镜术后患者食管pH值测定显示,60%的患者存在无症状反流和异常胃酸暴露。此外,胸腔镜下如对食管下段肌切开不彻底、术后吞咽困难症状易复发[19]。因此,在21世纪早期,大多数外科医生转为腹腔镜LCM,从胃-食管结合处向近端延伸4~7 cm,越过胃贲门至少2 cm,加部分前或后胃底折叠术。而经胸贲门肌层切开术仍是气囊扩张后穿孔的治疗方法之一[2,20]。
在改良的Heller手术中加入胃底折叠术一直是人们持续关注的领域。1962年,法国外科医生Vincent Dor建议在经腹贲门肌层切开术中增加前方的胃底折叠术以降低反流率[21]。2006年Richards等的一项随机对照试验,建议在Heller手术中加入Dor部分胃底折叠术,在长期预防术后反流方面更有效;虽然增加胃底折叠术导致手术时间和直接成本的增多,而没有胃底折叠术的患者的术后反流症状则需要延长质子泵抑制药治疗,在十年内的花费更多[22]。2011年,一项在60名患者中比较Dor与Toupet胃底折叠术的多中心前瞻性随机对照试验发现,两组之间在术后反流或其他食管术后并发症方面无显著差异。Dor组pH测试结果异常的患者较多,但差异无统计学意义[5]。还有一项144名接受LCM的患者随机对照试验,比较Dor与Nissen或完全胃底折叠术的疗效,研究发现,术后5年Nissen组(15%)的吞咽困难发生率高于Dor组(3%)[23]。美国胃肠和内镜外科医生协会(Society of American Gastrointestinal and Endoscopic Surgeons,SAGES)的最新指南建议进行部分胃底折叠术,但对于前路还是后路更优目前尚无共识[24]。
贲门肌层切开术用以治疗贲门失弛缓症的近期主要进展是机器人手术平台的日益普及和认可。北美使用最广泛的机器人平台结合了完全铰接的传动器械,以及高清晰3D可视化视野。从2005年以来机器人手术的经验表明,虽然与LCM相比机器人手术时间更长,但机器人辅助贲门肌层切开术导致术中食管穿孔率较低,并且对于经验丰富的腹腔镜外科医生来说,学习曲线更短[25-26]。
腹腔镜贲门肌层切开术:技术
患者选择
如上所述,谨慎选择符合手术适应证的患者是解决术后患者吞咽困难的关键。常规检查包括仔细询问病史、关注Eckard评分(贲门失弛缓症临床症状评分系统),该调查包括吞咽困难、反流、胸骨后疼痛和体重减轻(kg)等症状评分。根据频率(无、偶尔、每天、每餐)和体重减轻(0, <5 kg, 5~10 kg, >10 kg)(表1),对每个症状的严重程度进行评分。最终得分的范围在0~12之间,≥4分意味着病情较重,需要系统治疗干预。其他相关的合并症,如营养不良、误吸、复发性肺炎或慢性肺部病也应详细记录。需要与贲门失弛缓症相鉴别的其他综合征,包括假性食管蠕动障碍的结缔组织疾病,特别是系统性硬化症和CREST综合征(钙质沉着症、雷诺现象、食管运动障碍、硬化症和毛细血管扩张症)、自身免疫性疾病(如系统性淀粉样变性、结节病和南美锥虫病)、食管Chagas病。还应考虑假性贲门失弛缓症,与原发性贲门失弛缓症难以鉴别诊断;病史和体格检查可能提示反流病史长且症状性发作等,与原发性食管恶性肿瘤症状更相似。假性贲门失弛缓症的其他病因包括胸腔内肿物外压,如淋巴瘤、心脏肿瘤、支气管肿瘤或其他良性病变,如胰腺假性囊肿、间叶肿瘤或纵隔纤维化[27]。对患者既往做过任何内镜治疗的反应进行评估,包括球囊扩张、注射肉毒杆菌毒素或经口内镜下肌切开术(peroral endoscopic myotomy,POEM)。
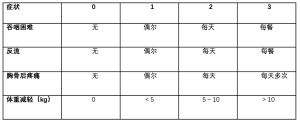
Full table
术前检查包括食管X线钡餐、内镜检查和食管高分辨率测压。有时,部分贲门失弛缓症患者的症状和影像学检查可能不典型。在这些情况下,48小时pH值测定可用于排除GERD(胃食管反流病)。在假性贲门失弛缓症中,高分辨率食管测压可显示食管下段括约肌“完全松弛”或常有松弛不全现象,有时原发性贲门失弛缓症影像学表现并不典型。内镜检查可能会发现腔内肿块或外压性表现。如果高度怀疑是假性贲门失弛缓症,还需要做胸部和腹部的CT扫描(或类似的横截面成像)。根据患者的年龄和合并症,完成必须的实验室检查和术前心肺功能评估[28]。
虽然该病对30~60岁的男性和女性患者的影响是相同的[17],但通常情况下,对于未进行内镜治疗的Ⅱ型贲门失弛缓症的年轻男性患者,LCM被认为是长期缓解症状的最佳解决方案,因此,在我们的中心,我们特别关注高风险患者的一般身体状况,其特征是他们能够独立生活、独立行走、维持体力活动、爬楼梯及他们的一般认知功能。目前,多个在线通用的风险计算器可供免费或付费使用。基于NSQIP数据的ACS风险计算器是一种出色的免费在线工具,可用于评估手术风险,尤其是在老年食管手术患者中。要鼓励患者进行康复性训练,特别注意日常适当的身体活动(每天步行1.6~3.2 km),并在身体可耐受的情况下通过液体补充剂增加蛋白质摄入量。
体位和戳卡的位置
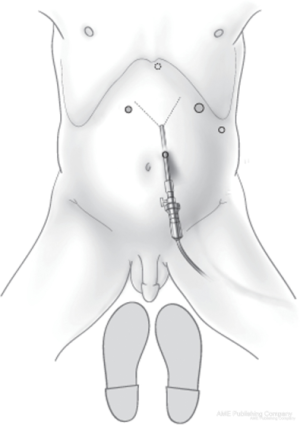
患者采用仰卧分腿截石体位(改良法式),以便外科医生站在患者双腿之间施行手术。患者双下肢在腿架上外展到30°~60°之间,用脚踏板以确保其足部自然屈曲。手臂置以衬垫后收拢,或外展80°固定在托手板上。也可以使用带有脚踏板的非分离式腿部手术台,外科医生通常从患者的右侧进行手术。在任一位置上,利用倾斜的反向头低脚高位(Trendelenburg position)便于肠道在重力作用下垂,从而获得最佳的手术间隙。
通常会采用一种被称为封闭式Veress技术,在Palmer点或脐部获得腹部通路,然后将腹部充气至15 mmHg。戳卡放置位置如下:11 mm摄像头戳孔,距剑突15 cm,在前正中线偏左侧;左上象限剑突12 cm肋缘下12 mm操作孔;右上象限剑突7~11 cm肋缘下5 mm操作孔,左侧腹部5 mm的辅助操作孔。自剑突水平戳孔放置Nathanson腹腔镜下肝脏牵开器(图1)。值得注意的是,摄像头端口放置在前正中线左侧可降低术后切口部位疝的风险,减少镰状韧带和肝左叶的视觉干扰,在游离食管周围间隙时便于更好的观察食管的解剖位置[9]。
手术技巧——关键步骤
解剖从进入肝胃韧带开始,注意保护迷走神经的肝脏分支。分离右侧膈食管韧带和右膈肌脚的界面,进入纵隔内并沿着膈脚的前部继续解剖。分离中尽可能少的使用能量器械,大部分从右到左的食管和纵隔前部解剖,都可使用两个无创伤的Hunter抓钳通过钝性分离完成。
分离左右膈食管韧带后,转向胃底的游离,为加做抗反流手术做准备。从脾脏下极水平开始处理胃短血管以增加胃底的暴露与游离,完成食管全周解剖,在胃底部形成一个后部空间,置入一根Penrose引流管绕过胃食管交界处。
接下来,分离部分胃食管交界处脂肪垫并显示左侧迷走神经前支,以便暴露LES的纵行肌肉纤维。注意仔细识别和保护迷走神经前支,此时Penrose引流管可向下牵引,充分暴露食管前表面。纵隔解剖须达到充分暴露食管前表面的程度。
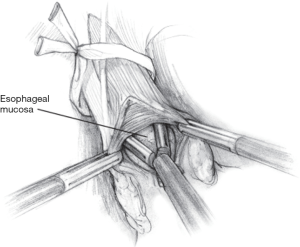
肌层切开术在靠近胃食管交界处的食管侧开始。助手牵拉食管旁脂肪垫提供反向牵引,主刀医生牵开食管的内侧边缘,显露胃食管交界处的平面。这样操作可以让主刀医生识别并快速切开纵向肌纤维,进而显露下方的环形肌纤维。然后使用锐性+钝性解剖的方法将环形肌纤维逐渐从黏膜下平面剥离并切断(图2)。
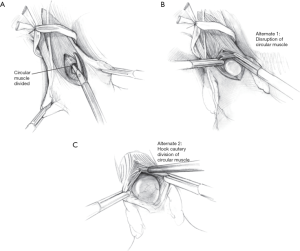
有三种方式可安全有效地切断环形肌纤维。第一种方法是使用腹腔镜 Metzenbaum剪刀将肌肉纤维快速离断(图3A)。第二种方法是端—端的肌肉撕裂法,主刀医生用两个无损伤钳紧紧抓住两侧环形肌纤维,并以缓慢可控的速度撕裂肌纤维(图3B)。不论使用锐性或者钝性分离导致的肌纤维出血都可使用纱布或止血海绵直接压迫控制。第三种方法是使用电钩烙断术,将环形肌纤维钩起并向上提拉使其远离食管黏膜下层,然后再切断。在短暂能量释放期间伴随着持续向上的张力。但这种方式不是最好选择,因为电钩的背面靠近黏膜下层有热损伤的风险(图3C)。
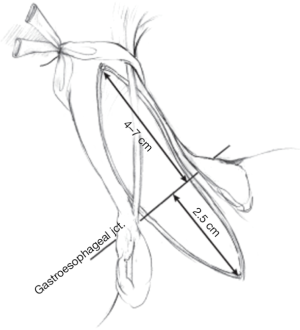
贲门肌层切开术从胃食管交界处向上切开4~7 cm处,向下达贲门上2~3 cm处,以类似的方法将交叉的悬吊纤维分离开(图4)。如为Ⅲ型贲门失弛缓症,可以施行更长的肌层切开术。肌层切开近端可在内镜引导下完成,同时也可进行检漏试验。通过在内窥镜下对食管腔注入气体,将切开部位食管的黏膜下层置于腹腔内盐水中观察。内窥镜检查和透照也可显示有无黏膜缺损。另一种检漏试验可用亚甲蓝稀释在250 mL生理盐水中,通过胃管注射到食管腔内。黏膜下层的变薄区域很容易染成蓝色。若观察到食管黏膜被损伤,要用小圆针细线或者细可吸收缝线(3-0或4-0)予以缝合。通常情况下,Dor部分胃底折叠术有助于支撑和保护食管肌层切开术。
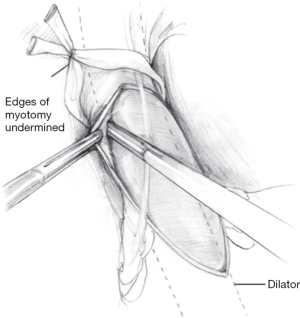
随后,麻醉人员或联合外科医生将56# Maloney扩张器放入胃中。该装置有助于判断肌层切开的是否充分,并可作为胃底折叠术的指引。在此操作过程中,外科医生和扩张器置入者之间保持持续的沟通至关重要,可防止因食管肌层切开术后扩张器置入而导致的穿孔。一旦放置成功,借助探条的牵引可显示残存的悬吊肌纤维。在彻底的肌层切开术中,外科医生应该能够观察到扩张器周围松弛的黏膜。如果发现肌层切开的部分比较紧,可以直接通过潜行钝性分离肌纤维以便将其与黏膜下层分开(图5)。
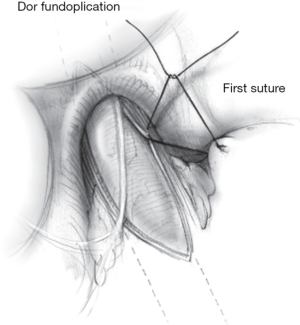
考虑到肌层切开术可能导致术后无“阻挡”的酸反流,贲门肌层切开术时我们会围绕扩张器加做部分胃底折叠术来抗反流。如前所述,Dor和Toupet的胃底折叠术在抗反流方面似乎没有区别。一些外科医生会进行Toupet胃底折叠术,将食管两侧胃组织固定在肌纤维的切缘上,这样做可能有助于保持切开的肌纤维处于分离状态。然而,这种方法可能会使食管向前移位,并可能导致轻度的吞咽困难。相反,前述的Dor胃底折叠术可保护暴露的黏膜下层,不需要向后方解剖食管。在Dor胃底折叠术中,第一针横向缝合尽可能包含左膈脚和肌层切开术的边缘(图6)。我们中心通常更喜欢使用这种方法[15]。在这两种手术方式中,可使用0号不可吸收的缝线(聚酯或丝线)来完成胃底折叠术[4,9,24]。
术后治疗
在拔管和麻醉复苏后,患者通常被转移到病房进行常规术后管理。在术后第一天进行水溶性造影剂X线检查,直到此时患者仍是禁食水状态。围手术期可使用止吐药,以防止恶心和干呕。采用多种模式的疼痛管理,非麻醉剂和冰袋比阿片类药物更受推荐。鼓励患者早期下床活动和给予积极的呼吸功能刺激。如果食管造影没有发现造影剂泄露,并且患者一般情况良好,则开始流质饮食。术后第一天或第二天患者被送回家,进行大约一周的浓稠或“全”流质饮食,然后进行为期三周的改良的软、低渣“post-Nissen”饮食。这种饮食可减少术后胃食管交界处的肿胀,防止患者感觉可能出现症状反复。出院的主要标准是能够耐受经口进食和非注射药物控制疼痛。
术后并发症
LCM术中食管黏膜损伤的风险高达7%,但很容易在术中进行修复[29-33]。迟发性食管穿孔是贲门肌层切开术后最严重的并发症。食管黏膜热损伤的后果可能在术后7天内随时出现。典型的表现是心动过速,然后出现发烧、呼吸急促和上腹部疼痛。如有上述症状应立即使用水溶性造影剂进行食管和上消化道造影。同时,患者按照腹腔脓毒症治疗,根据最新指南对患者进行复苏治疗并静脉注射抗生素。可放置Foley导管以准确记录尿量,以作为终末器官灌注的标志。如果患者情况稳定,可在影像学引导下穿刺引流。如果患者一般状况差,或者外引流后病情恶化,必须返回手术室进行反复冲洗和广泛引流。在极少数情况下,食管坏死或严重食管穿孔可能需要紧急食管切除术,还包括瘘口引流和胃造瘘术,待患者完全康复后再进行消化道的重建(术后8周或更长时间)。
贲门肌层切开术后数周至数年,如患者伴有吞咽困难症状反复发作时应进行全面检查,包括详细的病史和体格检查、食管造影、内窥镜检查,以及必要时进行食管测压。在复发性贲门失弛缓症或不完全性肌层切开的情况下,食管测压发现LES压力>10~15 mmHg[20]。术后可以通过球囊扩张术治疗狭窄,通过扩张可撕裂先前肌层切开手术区域的瘢痕组织。在极少数情况下,可以通过腹腔镜或POEM手术再次进行肌层切开术。然而,当LES压力<10 mmHg时,再次LCM的成功率很低。切除先前的胃底折叠区域可能有助于缓解吞咽困难。如果症状进展为终末期贲门失弛缓症和食管呈“S”样外观,可选择微创食管切除术。
机器人辅助贲门肌层切开术的作用
在美国,机器人平台的普及和由此给外科医生带来的舒适体验,导致机器人辅助贲门肌层切开术的增加。患者仰卧,双臂收拢,双脚在踏板上自然弯曲。四个戳卡在距离剑突15~18 cm的位置沿腹部呈直线或浅弧形放置。仍然使用Nathanson肝脏牵开器,但可以使用额外的机械臂和器械来抬起肝左叶。助手使用与腹腔镜入路相同的左侧辅助操作孔,并且能够将缝合线穿过8 mm机器人戳卡。高清3D镜头提供了清晰的纵行和环形食管肌纤维解剖,弥补了触觉反馈缺乏的不足。虽然仍然可以使用上述的锐性和撕裂方法,但机器人电钩提供了活动自如的“腕关节”,从而可以轻松解剖食管下段环形肌与黏膜下平面。机器人电钩用途广泛,既可用于钝性“反手”解剖,也可用于单个肌肉束的电灼分割。机器人胃底折叠术的手术方式与腹腔镜方法相似[30]。
结论
对于胃肠外科医生来说,贲门肌层切开术是一个在技术上具有挑战性和结果令人满意的案例。随着微创技术的不断发展,早期贲门失弛缓症的患者多会选择手术治疗。但这并不能代表可以削弱非手术治疗的作用,尤其是球囊扩张术。1989年,Csendes等人对比开放的食管肌层切开术和球囊扩张治疗的贲门失弛缓症患者,通过10年以上的长期随访结果显示,症状持续缓解率在球囊扩张组为65%,开放食管肌层切开组为85%。多年后,2011年,Boeckxstaens等人对201名新诊断为贲门失弛缓症的患者进行了一项随机试验,将充气球囊扩张术(30 mm)与腹腔镜Heller和Dor胃底折叠术的疗效进行比较,在2年的随访中,患者的症状、LES压力、食管排空和生活质量方面没有显著性差异[35]。
就手术而言,我们没有发现充气球囊扩张治疗会增加术中解剖的难度。相反,肉毒杆菌毒素注射会引起明显的炎症反应,从而增加解剖过程中黏膜损伤的概率。因此,肉毒杆菌毒素注射适合于无法耐受全身麻醉的高龄或一般情况较差的患者。偶尔,当贲门失弛缓症难以确诊时,可注射肉毒杆菌毒素明确诊断。
自2010年以来,POEM手术已成为治疗贲门失弛缓症的越来越重要的方法。2019年,Werner等人发表了他们的2年研究结果,该试验比较POEM与LCM+Dor胃底折叠术在有症状的贲门失弛缓症患者中的疗效。共有221名患者被随机分配接受POEM(112名患者)和LCM+Dor胃底折叠术(109名患者)。在这项随机试验中,2年期间POEM在控制贲门失弛缓症症状方面与LCM+Dor胃底折叠术相当,但在接受POEM治疗的患者中的胃食管反流症状比在接受LCM治疗的患者中更常见[36]。Andolfi和Fisichella对来自20项研究(583例LCM、449例POEM、58例肉毒杆菌毒素、485例球囊扩张术)合计1575名患者的荟萃分析显示,LCM对Ⅱ型贲门失弛缓症的成功率更高,而POEM似乎对Ⅲ期贲门失弛缓症患者的成功率更高,因为使用内窥镜的方法允许更长的肌层切开。尽管每项研究遵循的定量和定性指标略有不同,但治疗成功通常取决于术后症状的严重程度和缓解程度。作者使用加权平均值后认为POEM在Ⅰ型贲门失弛缓症患者中似乎更有效(95% POEM vs 81% LCM)[7]。然而,如前所述,由于Ⅰ型和Ⅱ型贲门失弛缓症之间的区别不如Ⅲ型贲门失弛缓症那么明确,LCM仍然是一种可接受的治疗方式,尤其是在缺乏熟练的内镜医生的情况下。
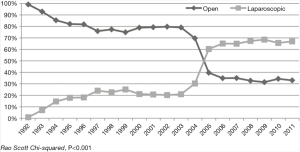
总之,各种治疗方法的不断进步,从机器人辅助到自然腔道手术,设备的改进有助于对贲门失弛缓症患者进行个体化治疗。2017年Haisely等人的一项研究,通过查询全国住院患者样本数据库(Nationwide Inpatient Sample database)了解贲门肌层切开术的趋势。该数据库包括美国超过700万的住院病例,每年有38个州的1000家医院报告。从1992年到2011年,作者发现出现了从开放的贲门肌层切开术向腹腔镜贲门肌层切开术的转变,在2005年出现了拐点(图7)。这也与贲门失弛缓症手术数量普遍增加,以及这些病例逐渐从乡村医院向城市大医院转移有关。从大规模城市教学医院向大的区域中心转移,贲门失弛缓症手术病例的增长也反映了其他复杂手术(如胰十二指肠切除术和食管切除术)的区域化趋势[37]。事实上,与其他复杂手术类似。Haisley等人发现随着住院时间和手术死亡率等指标显著改善,城市教学中心医院越来越受到青睐[3]。在我们中心,我们在多学科会议上(包括胃肠病学专家及外科医生)共同讨论贲门失弛缓症患者的诊断和干预策略,有助于优化贲门失弛缓症亚型患者的精准治疗。我们还讨论关于治疗方案失败的备选方案,包括POEM后的手术肌层切开术,以及终末期疾病的食管切除术。而事实上,这种多学科模式的形成与城市教学医院的专科特色密切相关。
随着外科治疗变得更加专业化,社区的外科医生和胃肠病学专家必须决定何时将贲门失弛缓症患者转诊到区域医疗中心进行治疗。患者应该被推荐进行按照评分治疗,还是在治疗失败后再转诊?此外,社区的外科医生是否应该接受培训后再进行这些手术?在我们的中心,该地区(美国太平洋西北部)的患者需要经过长途跋涉的路程才能到我院外科治疗。既往存在农村外科医疗资源的稀缺及社区外科医生专业知识匮乏的压力,随着健康服务体系的变化,社区外科医生的专业知识将会得到巨大的提高。
最后,随着机器人平台更加普及,机器人辅助的贲门肌层切开术被认为是贲门失弛缓症微创治疗中一个强大的武器。最近多项对过去十年经验的回顾性研究表明,机器人所特有的可视化视野和灵活机械臂,有助于降低食管穿孔发生率(在许多数据中报告为0)。另一项研究显示机器人手术可降低反流症状的复发[38]。后者可能是由于机器人辅助贲门肌层切开较长的原因,但手术时间差异无统计学意义。值得注意的是,并发症发生率与外科医生先前实施的手术病例数之间似乎没有任何相关性[30,31,38,39,40]。尽管如此,对于整个手术团队来说,机器人平台存在固有的学习曲线,并且由于仪器和设备维护而导致总体运营成本更高。外科医生的人体工程学优势很难量化,但大多数外科医生都认为,在这种充满挑战、精神紧张的情况下,从坐姿和头部、颈部、肩部、控制台位置,机器人平台可以提高术者舒适度。但在尝试这种高度专业化的手术之前,仍然建议外科医生在任何时候都需要熟练掌握腹腔镜或开放手术。
Acknowledgments
The authors would like to thank Tionna Foglio-Reed for her outstanding administrative support as well as Cory Sandonne for her excellent illustrations.
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor (Sarah Thompson) for the series “Achalasia” published in Annals of Esophagus. The article has undergone external peer review.
Conflicts of Interest: Both authors have completed the ICMJE uniform disclosure form (available at: http://dx.doi.org/10.21037/aoe-2019-ach-14). The series “Achalasia” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Schlottmann F, Patti MG. Esophageal achalasia: current diagnosis and treatment. Expert Rev Gastroenterol Hepatol 2018;12:711-21. [Crossref] [PubMed]
- Stavropoulos SN, Friedel D, Parkman HP, et al. Diagnosis and management of esophageal achalasia. BMJ 2016;354:i2785. [Crossref] [PubMed]
- Haisley KR, Preston JF, Hunter JG, et al. Twenty-year trends in the utilization of Heller myotomy for achalasia in the United States. Am J Surg 2017;214:299-302. [Crossref] [PubMed]
- Hunter JG, Trus TL, Waring P, et al. Laparoscopic Heller myotomy and fundoplication for achalasia. Ann Surg 1997;225:655-64. [Crossref] [PubMed]
- Rawlings A, Soper NJ, Oelschlager B, et al. Laparoscopic Dor versus Toupet fundoplication following Heller myotomy for achalasia: results of a multicenter, prospective, randomized-controlled trial. Surg Endosc 2012;26:18-26. [Crossref] [PubMed]
- Hamer PW, Holloway RH, Heddle R, et al. Evaluation of outcome after cardiomyotomy for achalasia using the Chicago classification. Br J Surg 2016;103:1847-54. [Crossref] [PubMed]
- Andolfi C, Fisichella PM. Meta-analysis of clinical outcome after treatment for achalasia based on manometric subtypes. Br J Surg 2019;106:332-41. [Crossref] [PubMed]
- Herbella FA, Patti MG. Laparoscopic Heller myotomy and fundoplication in patients with end-stage achalasia. World J Surg 2015;39:1631-3. [Crossref] [PubMed]
- Hunter JG, Spight DH, Sandone C, et al. Atlas of Minimally Invasive Surgical Operations. Available online: https://accesssurgery.mhmedical.com/content.aspx?bookid=2403§ionid=187824009
- Hung YC, Westfal ML, Kelleher CM, et al. Heller myotomy is the optimal index procedure for esophageal achalasia in adolescents and young adults. Surg Endosc 2019;33:3355-60. [Crossref] [PubMed]
- Bresadola V, Feo CV. Minimally invasive myotomy for the treatment of esophageal achalasia: evolution of the surgical procedure and the therapeutic algorithm. Surg Laparosc Endosc Percutan Tech 2012;22:83-7. [Crossref] [PubMed]
- Heller E. Extramucose Kardiaplastik beim chronischen Kardiospasmus mit Dilatation des Esophagus. Mitt Grenzgeb Med Chir 1914;27:141-9.
- McVey JL, Schlegel JF, Ellis FH Jr. Gastroesophageal sphincteric function after the Heller myotomy and its modifications. An experimental study. Bull Soc Int Chir 1963;22:419-23. [PubMed]
- Zaaijer JH. Cardiospasm in the aged. Ann Surg 1923;77:615-7. [Crossref] [PubMed]
- Abid S, Champion G, Koehler RE, et al. Treatment of achalasia: the best of both worlds. Am J Gastroenterol 1994;89:979-85. [PubMed]
- Pellegrini C, Wetter LA, Patti M, et al. Thoracoscopic esophagomyotomy. Initial experience with a new approach for the treatment of achalasia. Ann Surg 1992;216:291-6. [Crossref] [PubMed]
- Allaix ME, Patti MG. Endoscopic dilatation, Heller myotomy, and peroral endoscopic myotomy: treatment modalities for achalasia. Surg Clin North Am 2015;95:567-78. [Crossref] [PubMed]
- Shimi S, Nathanson LK, Cuschieri A. Laparoscopic cardiomyotomy for achalasia. J R Coll Surg Edinb 1991;36:152-4. [PubMed]
- Patti MG, Tamburini A, Pellegrini CA. Cardiomyotomy. Semin Laparosc Surg 1999;6:186-93. [PubMed]
- Richter JE. Update on the management of achalasia: balloons, surgery and drugs. Expert Rev Gastroenterol Hepatol 2008;2:435-45. [Crossref] [PubMed]
- Dor J, Humbert P, Dor V, et al. L’interet de la technique de Nissen modifiee dans la prevention de reflux apres cardiomyotomie extramuqueuse de Heller. Mem Acad Chir (Paris) 1962;88:877-83.
- Torquati A, Lutfi R, Richards WO, et al. Heller myotomy vs Heller myotomy plus Dor fundoplication: cost-utility analysis of a randomized trial. Surg Endosc 2006;20:389-93. [Crossref] [PubMed]
- Rebecchi F, Allaix ME, Morino M, et al. Laparoscopic Heller Myotomy and Fundoplication: What Is the Evidence? Am Surg 2018;84:481-8. [Crossref] [PubMed]
- Stefanidis D, Richardson W, Farrell TM, et al. SAGES guidelines for the surgical treatment of esophageal achalasia. Surg Endosc 2012;26:296-311. [Crossref] [PubMed]
- Afaneh C, Finnerty B, Zarnegar R, et al. Robotic-assisted Heller myotomy: a modern technique and review of outcomes. J Robot Surg 2015;9:101-8. [Crossref] [PubMed]
- Maeso S, Reza M, Mayol JA, et al. Efficacy of the Da Vinci surgical system in abdominal surgery compared with that of laparoscopy: a systematic review and meta-analysis. Ann Surg 2010;252:254-62. [Crossref] [PubMed]
- Gockel I, Eckardt VF, Junginger T, et al. Pseudoachalasia: A case series and analysis of the literature. Scand J Gastroenterol 2005;40:378-85. [Crossref] [PubMed]
- Jobe BA, Hunter JG, Watson DI. Esophagus and Diaphragmatic Hernia. In: Brunicardi F, Andersen DK, Billiar TR, et al. editors. Schwartz's Principles of Surgery. 11 edition. New York, NY: McGraw-Hill, 2019.
- Litle VR. Laparoscopic Heller myotomy for achalasia: a review of the controversies. Ann Thorac Surg 2008;85:S743-6. [Crossref] [PubMed]
- Rebecchi F, Allaix ME, Morino M. Robotic technological aids in esophageal surgery. J Vis Surg 2017;3:7. [Crossref] [PubMed]
- Huffmanm LC, Pandalai PK, Boulton BJ, et al. Robotic Heller myotomy: a safe operation with higher postoperative quality-of-life indices. Surgery 2007;142:613-8. [Crossref] [PubMed]
- Cowgill SM, Villadolid D, Boyle R, et al. Laparoscopic Heller myotomy for achalasia: results after 10 years. Surg Endosc 2009;23:2644-9. [Crossref] [PubMed]
- Rosemurgy AS, Morton CA, Rosas M, et al. A single institution’s experience with more than 500 laparoscopic Heller myotomies for achalasia. J Am Coll Surg 2010;210:637-45, 645-7.
- Csendes A, Braghetto I, Henríquez A, et al. Late results of a prospective randomized study comparing forceful dilatation and oesophagomyotomy in patients with achalasia. Gut 1989;30:299-304. [Crossref] [PubMed]
- Boeckxstaens GE, Annese V, des Varannes SB, et al. Pneumatic dilation versus laparoscopic Heller’s myotomy for idiopathic achalasia. N Engl J Med 2011;364:1807-16. [Crossref] [PubMed]
- Werner YB, Hakanson B, Martinek J, et al. Endoscopic or Surgical Myotomy in Patients with Idiopathic Achalasia. N Engl J Med 2019;381:2219-29. [Crossref] [PubMed]
- Merath K, Mehta R, Tsilimigras DI, et al. Quality of Care Among Medicare Patients Undergoing Pancreatic Surgery: Safety Grade, Magnet Recognition, and Leapfrog Minimum Volume Standards-Which Quality Benchmark Matters? J Gastrointest Surg 2020; [Epub ahead of print]. [Crossref] [PubMed]
- Kim SS, Guillen-Rodriguez J, Little AG. Optimal surgical intervention for achalasia: laparoscopic or robotic approach. J Robot Surg 2019;13:397-400. [Crossref] [PubMed]
- Shaligram A, Unnirevi J, Oleynikov D, et al. How does the robot affect outcomes? A retrospective review of open, laparoscopic, and robotic Heller myotomy for achalasia. Surg Endosc 2012;26:1047-50. [Crossref] [PubMed]
- Milone M, Manigrasso M, Vertaldi S, et al. Robotic versus laparoscopic approach to treat symptomatic achalasia: systematic review with meta-analysis. Dis Esophagus 2019;32:1-8. [Crossref] [PubMed]
- Horgan S, Galvani C, Gorodner MV, et al. Robotic-assisted Heller myotomy versus laparoscopic Heller myotomy for the treatment of esophageal achalasia: multicenter study. J Gastrointest Surg 2005;9:1020-9. [Crossref] [PubMed]
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Rajdev PA, Hunter JG. Laparoscopic cardiomyotomy: historical overview and current operative approach. Ann Esophagus 2020;3:34.




