食管高级别不典型增生:何时手术?——系统回顾
引文
内镜治疗食管高级别不典型增生(HGD)是食管切除术的替代方案,于1992年被首次提出,自2009年以来已被公认为标准治疗方案[1,2]。在此之前,由于食管恶性肿瘤和Barrett’s食管(BE)患者的HGD之间存在关联,因此食管切除术是标准治疗方案。每年不到1%的BE患者会发展为HGD,但这些患者中有多达40%会继续发展为浸润性腺癌[3-5]。大多数HGD患者现在可以通过内镜选择进行联合治疗;包括内镜黏膜切除术(EMR)、内镜黏膜下剥离术(ESD)、射频消融术(RFA)、氩等离子体凝固术(APC)和冷冻消融术[6-10]。这些治疗已成为大多数HGD或浅表食管癌患者的首选治疗方法,因为与食管切除术相比,保留了食管、有相似的长期生存率及明显更少的并发症[11]。
虽然内镜治疗优于手术治疗HGD,但仍缺乏可以选择出哪些患者能从手术治疗中受益的指南[12]。许多外科医生认为食管切除术更适合食管功能差、合并严重和(或)无法控制的反流症状、吞咽困难或频繁误吸的患者[13]。本系统综述旨在检索当前文献,以确定手术在HGD治疗中的作用。
数据来源
从2010年1月—2018年12月,通过搜索MEDLINE数据库确定了针对18岁以上人群的英文研究论文。1992年Inoue博士首次发表了透明帽法(EMR with a cap,EMRC),然而,直到2009年内镜治疗HGD才成为可接受的标准治疗[1,2]。因此,仅考虑2009年之后发表的研究论文。
研究选择
三名独立评估者分析了所有纳入的论文。用于识别文章的关键词包括“食管高级别不典型增生”和“手术”。根据纳入和排除标准对所有确定的文章进行系统评估。然后分析符合纳入标准的文章参考文献列表,以进一步确定潜在的相关性研究。所有检索到的引文都经过分析,以确定所有HGD患者的治疗方案和结果对比的实验、队列或病例对照研究。
选择标准
患者被诊断为HGD或Barrett’s食管不典型增生的研究被纳入分析,病例报告和评论文章被排除,仅纳入回顾性或前瞻性研究。在阅读全文后,如果未评估或提及手术干预或转诊手术,则排除后续研究。
数据提取
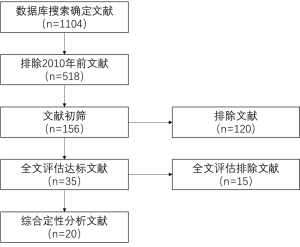
论文的文字、图片和表格都经过审核。三名研究者(SG Worrell, KE Bingmer, A Ofshteyn)分析了那些通过排除和纳入标准选择的研究。两位评论者之间的分歧通过讨论解决,直到达成共识。自1992年以来发表了1 104篇论文,自2010年以来发表了518篇论文。518篇论文都使用上述筛选标准进行了审核和排除,包含排除病例报告、基础科学论文和评论文章。在此之后,还剩下156篇论文。对全部156篇稿件的摘要进行了审核,选择了35篇论文进行单独分析。最终选择确定了20篇论文(图1)纳入分析。
数据合成
在经过全面审核的35项研究中,有20篇论文同时提到了内镜治疗和手术,并被纳入了本次分析。在这20项研究中,没有随机对照试验,但这些研究总共包括至少781名单独患有HGD的患者和超过1 566名患有HGD或黏膜内腺癌(IMC)的患者。
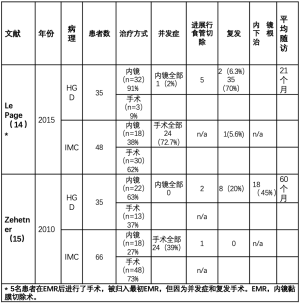
只有两项研究直接比较了内镜和手术治疗的结果(表1)[14,15]。这两项研究都是回顾性的,包括HGD和IMC。内镜下切除率为45%~70%,复发率为6%~20%[14,15]。
Full table
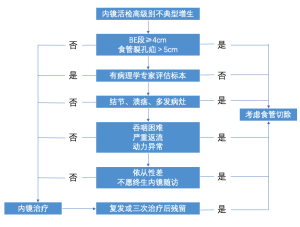
其余18项研究为非对比性病例对照研究。手术指征是进展为癌症、未能完全切除病变或在HGD切除后随访期间出现HGD或IMC复发,总体转诊手术率为0~24%。在这18篇文章中有14篇讨论了不同干预下HGD的结局。其他四篇文章仅讨论了成本效益和手术结果,并在相应的小节中进行了讨论。14项研究的具体结果见表2,包括手术率、临床结局和复发率。这些研究证明了与内镜治疗相关的一些不良结果。治疗后狭窄率为2%~26%,在接受ESD技术治疗的患者中更高。不典型增生的复发率为3%~21%,大多数复发发生在初始治疗后的两年内。所有治疗的总体5年生存率在77%~91%之间。考虑到特殊情况的治疗决策流程,如下所述,详见图2。
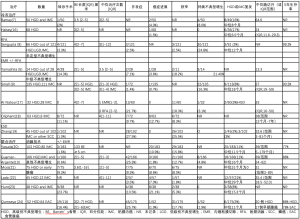
Full table
病理学专业评估
内镜下治疗HGD和IMC的一个潜在被忽视的禁忌是缺乏可靠的能准确判读内镜标本的病理学家,以及能提供可靠标本的内镜医师。
在Small及其同事的论文中,旨在将根除HGD和IMC与EMR +/- 消融进行比较,他们发现29%(54/189)最初转诊接受HGD治疗的BE患者罹患食管癌。大多数患者有IMC,但有2%(4/189)具有更多侵袭性病理改变,需要行食管切除[9]。
此外,在另一项对67名患者进行活检符合HGD的研究中,内镜切除(ER)标本显示癌症为19%(13/67),黏膜下腺癌为7%(5/67)[21]。
美国胃肠病学会(ACG)指南也承认观察者间存在变异性,他们建议任何级别的不典型增生的任何诊断都应由两名病理学家复核,其中至少一名具有胃肠(GI)病理学方面的专业知识[25]。
内镜治疗失败的风险
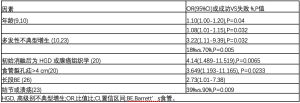
有大食管裂孔疝和较长段BE的患者,不太可能用RFA完全根除不典型增生[8]。在121名不典型增生患者的队列中,91名患者(75%)通过单次RFA治疗完全根除[8]。3名患者(3%,3/91)出现不典型增生的复发。在121名患者中,4名患者(3%)由于持续性不典型增生进而完成食管切除术。RFA后不典型增生的不完全根除与BE长度相关[7 cm(IQR,4~10 cm) vs 4 cm (IQR,2~6 cm),P=0.004]。食管裂孔疝也与根除不完全有关。有83%未完全根除的患者和55%完全根除不典型增生的患者存在食管裂孔疝,P=0.005。尽管该研究中缺乏关于切除范围和疝大小的详细数据,但其他研究表明,食管裂孔疝>4 cm和初始消融后为HGD或腺癌的组织学特征与消融后腺癌的复发显著相关[20]。此外,在一项对90名接受EMR消融的患者的研究中,只有长段BE是不典型增生或BE复发的独立预测因子,比值比(OR)2.73,95% CI:1.01~7.38[26]。在一项对166名接受EMR和消融治疗的患者的研究中,8名患者(4.8%)出现治疗失败。所有无法完全根除的患者在初始治疗时都罹患多灶性HGD,7名患者患有长节段BE(≥5 cm)。有3例HGD进展为癌症[10]。所有确定的复发和根除失败的风险因素都列在表3中。内镜治疗失败中食管裂孔疝的确切大小和BE长度尚待进一步确定。然而,这些研究已表明食管裂孔疝>4 cm和BE长度≥5 cm时不太可能完全根除不典型增生[8,10,20,26]。
患者有必要在很长一段时间内对多种治疗保持依从性。大多数患者需要不止一种治疗方式来根治疾病。在一项对166例患者进行的研究中,其中105例患有HGD,71例患有黏膜内癌的患者都接受了多种方式的内镜治疗,只有32%(53/166)的患者仅通过一次治疗完全根除了不典型增生[10]。在同一项研究中,3例患者在初始内镜治疗后HGD持续长达50个月[10]。
目前还没有论文评估那些食管动力差、出现无法控制的反流症状、吞咽困难或频繁误吸患者的临床结局。因此,还不能就内镜干预对这些患者的适用性做出任何确切声明。
内镜治疗后食管切除术
一项多中心的研究证实了与内镜治疗失败相关的发现,在转诊手术的患者中,73%的患者罹患长节段BE,93%的患者罹患结节或溃疡,91%的患者在初始内镜检查时发现有多灶性病变[27]。这一系列中的患者在转诊手术前平均接受了13个月(4~36个月范围)的内科治疗。患者被转诊接受手术是由于疾病的病理进展(53%)、未能清除疾病(33%)或在随访期间HGD或IMC切除后复发(13%)。20%的患者在内镜治疗期间出现狭窄。在最终的手术病理结果中,4名患者(27%)在切除时患有黏膜下癌,其中3名患者(占总入组的20%)淋巴结(LNs)呈阳性。这4名患者在初始内镜检查时可能就患有IMC,仍接受了更多的内镜治疗。本研究得出的结论是,由于还缺乏已发表的指南,当内镜医生在3次RFA疗程后仍无法根除上皮不典型增生、患者在活检中发现IMC或结节性Barrett’s食管和(或)患者在治疗期间出现狭窄,都应讨论分期重估和考虑手术[27]。
成本效益
内镜治疗包括持续随访,比食管切除术更具成本效益。马尔可夫模型表明,与食管切除术相比,接受EMR和RFA联合治疗的65岁患者可节省21.8万美元的成本[28]。然而,对于每年有30%进展为癌症的HGD变体食管切除术则更具成本优势,这些变体在模型中被确定为溃疡性、结节性和弥漫性HGD。此外,筛查以期在疾病早期识别患者可能会节省成本,因为早期食管癌的治疗成本低于需要多模式治疗的晚期癌症。与目前的实践相比,BE筛查计划中早期检测的潜在增量收益最大,通过将20%的T3期癌症患者前移到HGD或T1,从而可获得4 971美元的收益[29]。
随访
内镜治疗后复发可能会在较长的时间间隔内发生。在一项对90名有不典型增生复发患者的长期随访研究中,在完全内镜下根除后,复发时间中位数为治疗后44个月,最长为85个月[26]。完全根除后HGD的5年总体复发率为13.5%[9]。
生存情况
成功内镜治疗后HGD患者的5年生存率似乎与手术相当(表2)。尽管缺乏前瞻性的对比研究,但内镜治疗和手术治疗HGD的总生存率相似。HGD食管切除术后的5、10和15年生存率为94%、82%和75%[30]。EMR+/-消融后的5年和8年生存率分别为90.2%和79.9%[9]。
胃底折叠术的作用/频率
只有3篇论文提到使用胃底折叠术来控制反流。在全部20篇论文,超过781名HGD患者中,有6例Nissens胃底折叠术患者预先采取内镜治疗,有13例在内镜治疗后进行手术。值得注意的是,大多数接受胃底折叠术的患者都由外科医生而不是消化内科医生进行内镜治疗。还没有采用胃底折叠术相关的对比或结局的报告发表[6,22,23]。
讨论
HGD的诊断和治疗是一个不断发展的复杂问题。Inoue于1992年就引入了EMR的概念,在Ell和同事的研究结果显示内镜治疗成功且发病率和死亡率低[1,31]后,应用内镜来治疗HGD和IMC在随后的十年中并未被普及。内镜治疗自2009年被认可后一直在发展,新的技术和方法也在不断开发。
虽然内镜治疗通常是成功的,并允许保存食管,但部分患者需要多次治疗和(或)面临很高的疾病复发风险。某些尚未确切定义的患者,应考虑食管切除术作为一线治疗。对于内镜治疗失败的患者,应考虑食管切除术作为挽救性治疗。
食管切除术是一项复杂的手术,具有显著的发病率和死亡率。现代的治疗结局已降低了死亡率,目前低于5%[32,33]。主要并发症发生率为33%。最常见的主要并发症包括肺炎、再次气管插管和吻合口瘘[33]。内镜治疗可以以最小的风险进行,尽管并发症仍然存在。据报道,大约有3%的患者发生了内镜治疗后的严重不良事件,联合治疗后食管狭窄率3%~26%不等。此外,狭窄率随着切除周长的百分比和切除标本的数量而增加[34]。
然而,内镜治疗HGD和IMC有几个问题。一个重要的问题是病理学家是否有适当的专业知识来区分HGD和IMC。一项研究发现,社区病理医师有30%的时间无法从HGD标本中鉴别出浸润性癌[9]。此外,当进行内镜切除(ER)时,可能会对标本产生误读。在一项对25例ER标本的多机构研究中,研究型病理学家和社区初级病理评估之间的不一致性(48%)高得惊人[35]。病理诊断是驱动决策评估的因素。因此,了解病理检查项目的机构局限性将有助于为HGD患者制定一个成功的内镜随访和治疗计划。
由于病理学家难以区分HGD、IMC和黏膜下癌,因此许多文献将高级别不典型增生和早期食管癌合并为一类[36]。然而,这是两个本质上不同的疾病过程。IMC越来越多地采用与HGD相同的评估进行治疗,在考虑手术切除前接受了多次内镜治疗。然而,IMC仍有3%的风险累及淋巴结[37,38]。如果IMC在治疗期间进展为黏膜下癌,淋巴结受累率可达20%。淋巴结受累的患者5年生存率为45%~67%,与早期食管癌患者90%~95%的5年生存率相比显著降低[39,40]。淋巴结受累有明确的组织学特征:分化差、淋巴血管浸润和多灶性HGD[41]。当在内镜切除标本中发现这些特征时,应强烈考虑进行食管切除术。虽然有大量证据表明,低风险IMC可以通过内镜治疗治愈,但未来的研究应该将这两种疾病过程分开,以便更好地单独定义内镜下HGD和IMC的结局。
那些具有长节段BE(≥5 cm)、多灶性不典型增生病变、严重反流症状、大食管裂孔疝或吞咽困难的符合手术条件的患者构成一个具有挑战性的群体,是选外科治疗或是内镜治疗。其他综述文章已经阐述了普遍看法,即这些患者可能通过食管切除术得到更好的治疗。具体而言,长节段BE、大肿瘤、可见溃疡、食管裂孔疝或既往胃底折叠术后应考虑手术治疗,而不是内镜治疗[42]。
大多数评估内镜治疗HGD效果的研究都未曾提到手术。他们继续在内镜下重新治疗复发,并且不讨论转诊手术的时机。这些研究排除了进展为癌症的患者,这可能就是患者该被转诊进行手术切除的时间。文献中的这一空白引出了一个问题:什么时候该停止内镜治疗HGD并考虑手术治疗?Hunt及其同事建议,当内镜医师在3次RFA疗程后仍无法根治上皮不典型增生时,患者的活检或结节性Barrett's食管有IMC,和(或)患者在治疗期间出现狭窄,应重新分期并考虑手术,由于尚未有已发表的指南可参考,需要与患者进行讨论[27]。这些指导方针似乎是合理的。然而,没有论文显示治疗次数或狭窄的存在与治疗失败有关。如果患者知晓内镜治疗的潜在后果,那么反复进行的治疗次数可能对其长期结果没有意义。此外,内镜治疗的狭窄可能是表浅的,可通过扩张进行治疗。在一项接受光动力治疗(PDT)的患者的研究中,94%的PDT后狭窄的患者在完成多次扩张治疗后的2 年随访期内没有发现狭窄[43]。由于内镜治疗的重复性,对于那些不太可能接受反复内镜检查和随访的患者,应该考虑采用食管切除术进行更明确的治疗。本综述确定了与治疗失败相关的多个因素:初次治疗后出现结节或溃疡、多灶性不典型增生、大食管裂孔疝、长段BE和持续性HGD[9,10,20,31]。
在接受内镜治疗HGD前,应向患者告知其后续的终生随访。基于内镜治疗85个月后不典型增生复发的报道,告知就非常有必要[26]。在一项对患者中位随访6.8年的研究中,在完全根除肠化生后,肠化生和HGD的复发风险为40%[44]。更值得关注的是,随着时间的推移复发的风险并未降低[45]。ACG建议BE合并HGD治疗后随访为第一年每3个月随访一次,第二年每6个月随访一次,之后每年随访一次[25]。
仍然有问题需要解决的人群是那些被诊断为伴有严重反流、动力障碍或吞咽困难的HGD患者。这群患者可能患有食管疾病,内镜治疗效果不佳,更适合手术切除,然而,目前还没有研究专门解决这个问题。
另一个悬而未决的问题是,一旦确诊了HGD,哪种内镜治疗方案能带来最佳的长期疗效和最低的并发症。从本综述来看,联合疗法在复发和生存方面最成功,狭窄率较低或相当。如果只使用一种治疗方案,而不能完全根除不典型增生和肠化生,就会导致早期复发。内镜治疗的选项仍在不断更新,理想的治疗尚未确定。不管采用何种技术,成功的关键显然是彻底根除肠化生。如果不能完全根除,则BE、HGD和IMC复发的风险较高[46,47]。
此外,在本综述讨论的范围之外,胃底折叠术和内镜治疗的作用有所增加。本综述中,在内镜治疗后接受胃底折叠术的患者更可能是由外科医生而不是消化内科医师施行内镜治疗。ACG建议BE患者不应将抗反流手术当作抗肿瘤举措。然而,在药物优化治疗后反流症状控制不到位的患者中,应考虑行胃底折叠术[25]。
本研究的主要局限性在于它是对具有不同选择标准的多项研究的回顾。此外,随着内镜治疗变得更加传统,也有新的治疗方案可用。其中一些新选择可能会改善HGD内镜治疗的结果,并最终使HGD手术淘汰。在这些方法被证实具有较低的复发率之前,食道切除术在这种疾病治疗中仍有一定的作用。在本综述讨论范围之外的各种内镜疗法的有效性差异回顾。很难真正比较这些患者,因为许多内镜治疗研究将需要手术或内镜切除不完整的患者排除在最终研讨之外。另一个重要的限制是,大部分文献将HGD和IMC癌症合并为一组,尽管我们试图尽可能将它们分开,只分析HGD患者。
综上所述,大多数患者都适合进行内镜干预HGD治疗。在开始内镜治疗之前,所有的患者都应该进行多学科讨论。不同消融技术和内镜切除联合治疗可提供最佳的短期结果,但有较高的复发风险,这些患者需要长期随访。对于初次治疗后出现结节或溃疡、多灶性不典型增生、大食管裂孔疝、长节段BE或持续性HGD的患者应被告知其复发及失败风险的增加。应该向这些患者介绍食管切除术的风险和获益。此外,患者应该了解食管狭窄和疾病进展的风险,以及在接受内镜治疗而非食管切除术治疗HGD之前明确需终生随访和治疗的必要性。
Acknowledgments
Funding: None.
Footnote
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/aoe.2020.01.01). CWT reports personal fees from Atricure, personal fees from Sig Medical, personal fees from Zimmer Biomet, personal fees and non-financial support from Medtronic, outside the submitted work. The other authors have no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Inoue H, Endo K, Takeshita K, et al. A new simplified technique of endoscopic esophageal mucosal resection using a cap-fitted panendoscope (EMRC). Surg Endosc 1992;6:264-5. [Crossref] [PubMed]
- Fernando HC, Murthy SC, Hofstetter W, et al. The society of thoracic surgeons practice guideline series: guidelines for the management of barrett’s esophagus with high-grade dysplasia. Ann Thorac Surg 2009;87:1993-2002. [Crossref] [PubMed]
- Jung KW, Talley NJ, Romero Y, et al. Epidemiology and natural history of intestinal metaplasia of the gastroesophageal junction and Barrett's esophagus: a population-based study. Am J Gastroenterol 2011;106:1447-55. [Crossref] [PubMed]
- Davila ML, Hofstetter WL. Endoscopic management of Barrett’s esophagus with high-grade dysplasia and early-stage esophageal adenocarcinoma. Thorac Surg Clin 2013;23:479-89. [Crossref] [PubMed]
- Shaheen NJ, Crosby MA, Bozymski EM, et al. Is there publication bias in the reporting of cancer risk in Barrett’s esophagus? Gastroenterology 2000;119:333-8. [Crossref] [PubMed]
- Yamashita DT, Li C, Bethune D, et al. Endoscopic mucosal resection for high-grade dysplasia and intramucosal carcinoma: a Canadian experience. Can J Surg 2017;60:129-33. [Crossref] [PubMed]
- Ramay FH, Cui Q, Greenwald BD. Outcomes after liquid nitrogen spray cryotherapy in Barrett's esophagus-associated high-grade dysplasia and intramucosal adenocarcinoma: 5-year follow-up. Gastrointest Endosc 2017;86:626-32. [Crossref] [PubMed]
- Sengupta N, Ketwaroo GA, Bak DM, et al. Salvage cryotherapy after failed radiofrequency ablation for Barrett's esophagus-related dysplasia is safe and effective. Gastrointest Endosc 2015;82:443-8. [Crossref] [PubMed]
- Small AJ, Sutherland SE, Hightower JS, et al. Comparative risk of recurrence of dysplasia and carcinoma after endoluminal eradication therapy of high-grade dysplasia versus intramucosal carcinoma in Barrett's esophagus. Gastrointest Endosc 2015;81:1158-66.e1-4.
- Guarner-Argente C, Buoncristiano T, Furth EE, et al. Long-term outcomes of patients with Barrett's esophagus and high-grade dysplasia or early cancer treated with endoluminal therapies with intention to complete eradication. Gastrointest Endosc 2013;77:190-9. [Crossref] [PubMed]
- Worrell S, DeMeester SR. Endoscopic Resection and Ablation for Early-Stage Esophageal Cancer. Thorac Surg Clin 2016;26:173-6. [Crossref] [PubMed]
- Bennett C, Vakil N, Bergman J, et al. Consensus statements for management of Barrett's dysplasia and early-stage esophageal adenocarcinoma, based on a Delphi process. Gastroenterology 2012;143:336-46. [Crossref] [PubMed]
- DeMeester SR. Evaluation and treatment of superficial esophageal cancer. J Gastrointest Surg 2010;14:S94-100. [Crossref] [PubMed]
- Le Page PA, Velu PP, Penman ID, et al. Surgical and endoscopic management of high grade dysplasia and early oesophageal adenocarcinoma. Surgeon 2016;14:315-21. [Crossref] [PubMed]
- Zehetner J, DeMeester SR, Hagen JA, et al. Endoscopic resection and ablation versus esophagectomy for high-grade dysplasia and intramucosal adenocarcinoma. J Thorac Cardiovasc Surg 2011;141:39-47. [Crossref] [PubMed]
- Halsey KD, Chang JW, Waldt A, Greenwald BD. Recurrent disease following endoscopic ablation of Barrett's high-grade dysplasia with spray cryotherapy. Endoscopy 2011;43:844-8. [Crossref] [PubMed]
- Al Natour RH, Catanzaro A, Zolotarevsky E, et al. Endoscopic therapy for Barrett's high grade dysplasia and intramucosal esophageal cancer is effective in community clinical practice by advanced endoscopists following multidisciplinary approach. Dis Esophagus 2018;31:1-6. [Crossref] [PubMed]
- Oliphant Z, Snow A, Knight H, et al. Endoscopic resection with or without mucosal ablation of high grade dysplasia and early oesophageal adenocarcinoma--long term follow up from a regional UK centre. Int J Surg 2014;12:1148-50. [Crossref] [PubMed]
- Zhang YQ, Chen T, Zhang C, et al. Endoscopic Submucosal Dissection for Superficial Proximal Esophageal Neoplasia is Highly Successful. Ann Surg 2017;266:995-9. [Crossref] [PubMed]
- Yasuda K, Choi SE, Nishioka NS, et al. Incidence and predictors of adenocarcinoma following endoscopic ablation of Barrett's esophagus. Dig Dis Sci 2014;59:1560-6. [Crossref] [PubMed]
- Moss A, Bourke MJ, Hourigan LF, et al. Endoscopic resection for Barrett's high-grade dysplasia and early esophageal adenocarcinoma: an essential staging procedure with long-term therapeutic benefit. Am J Gastroenterol 2010;105:1276-83. [Crossref] [PubMed]
- Lada MJ, Watson TJ, Shakoor A, et al. Eliminating a need for esophagectomy: endoscopic treatment of Barrett esophagus with early esophageal neoplasia. Semin Thorac Cardiovasc Surg 2014;26:274-84. [Crossref] [PubMed]
- Hunt BM, Louie BE, Schembre DB, et al. Outcomes in patients who have failed endoscopic therapy for dysplastic Barrett's metaplasia or early esophageal cancer. Ann Thorac Surg 2013;95:1734-40. [Crossref] [PubMed]
- Qumseya BJ, Panossian AM, Rizk C, et al. Survival in esophageal high-grade dysplasia/adenocarcinoma post endoscopic resection. Dig Liver Dis 2013;45:1028-33. [Crossref] [PubMed]
- Shaheen NJ, Falk GW, Iyer PG, et al. ACG clinical guideline: diagnosis and management of Barrett’s esophagus. Am J Gastroenterol 2016;111:30-50. [Crossref] [PubMed]
- Anders M, Bähr C, El-Masry MA, et al. Long-term recurrence of neoplasia and Barrett's epithelium after complete endoscopic resection. Gut 2014;63:1535-43. [Crossref] [PubMed]
- Hunt BM, Louie BE, Dunst CM, et al. Esophagectomy for failed endoscopic therapy in patients with high-grade dysplasia or intramucosal carcinoma. Dis Esophagus 2014;27:362-7. [Crossref] [PubMed]
- Hu Y, Puri V, Shami VM, Stukenborg GJ, et al. Comparative Effectiveness of Esophagectomy Versus Endoscopic Treatment for Esophageal High-grade Dysplasia. Ann Surg 2016;263:719-26. [Crossref] [PubMed]
- Gordon LG, Hirst NG, Mayne GC, et al. Modeling the cost-effectiveness of strategies for treating esophageal adenocarcinoma and high-grade dysplasia. J Gastrointest Surg 2012;16:1451-61. [Crossref] [PubMed]
- Rice TW, Murthy SC, Mason DP, et al. Esophagectomy for clinical high-grade dysplasia. Eur J Cardiothorac Surg 2011;40:113-9. [Crossref] [PubMed]
- Pech O, May A, Manner H, et al. Long-term efficacy and safety of endoscopic resection for patients with mucosal adenocarcinoma of the esophagus. Gastroenterology 2014;146:652-660.e1. [Crossref] [PubMed]
- Schieman C, Wigle DA, Deschamps C, et al. Patters of operative mortality following esophagectomy. Dis Esophagus 2012;25:645-51. [Crossref] [PubMed]
- Society of Thoracic Surgeons General Thoracic Surgery Database Task Force. The Society of Thoracic Surgeons Composite Score for Evaluating Esophagectomy for Esophageal Cancer. Ann Thorac Surg 2017;103:1661-7. [Crossref] [PubMed]
- Lewis JJ, Rubenstein JH, Singai AG, et al. Factors associated with esophageal stricture formation after endoscopic mucodal resection for neoplastic Barrett’s esophagus. Gastrointest Endosc 2011;74:753-60. [Crossref] [PubMed]
- Worrell SG, Boys JA, Chandrasoma P, et al. Inter-Observer Variability in the Interpretation of Endoscopic Mucosal Resection Specimens of Esophageal Adenocarcinoma: Interpretation of ER specimens. J Gastrointest Surg 2016;20:140-4; discussion 144-5. [Crossref] [PubMed]
- Goldblum JR. Controversies in the Diagnosis of Barrett Esophagus and Barrett-Related Dysplasia: One Pathologist's Perspective. Arch Pathol Lab Med 2010;134:1479-84. [PubMed]
- Leers JM, DeMeester SR, Oezcelik A, et al. The prevalence of lymph node metastases in patients with T1 esophageal adenocarcinoma a retrospective review of esophagectomy specimens. Ann Surg 2011;253:271-8. [Crossref] [PubMed]
- Nigro JJ, Hagen JA, DeMeester TR, et al. Prevalance and location of nodal metastases in distal esophageal adenocarcinoma confined to the wall: implications for therapy. J Thorac Cardiovasc Surg 1999;117:16-23. [Crossref] [PubMed]
- Molena D, Schlottmann F, Boys JA, et al. Esophagectomy Following Endoscopic Resection of Submucosal Esophageal Cancer: a Highly Curative Procedure Even with Nodal Metastases. J Gastrointest Surg 2017;21:62-7. [Crossref] [PubMed]
- Reed MF, Tolis G Jr, Edil BH, et al. Surgical treatment of esophageal high grade dysplasia. Ann Thorac Surg 2005;79:1110-5. [Crossref] [PubMed]
- Boys JA, Worrell SG, Chandrasoma P, et al. Can the risk of lymph node metastases be gauged in endoscopically resected submucosal esophageal adenocarcinomas? A multi-center study. J Gastrointest Surg 2016;20:6-12. [Crossref] [PubMed]
- McLaren PJ, Dolan JP. Surgical Treatment of High-Grade Dysplasia and Early Esophageal Cancer. World J Surg 2017;41:1712-8. [Crossref] [PubMed]
- Overholt BF, Wang KK, Burdick JS, et al. Five-year efficacy and safety of photodynamic therapy with Photofrin in Barrett's high-grade dysplasia. Gastrointest Endosc 2007;66:460-8. [Crossref] [PubMed]
- Schwameis K, Zehetner J, Green KM, et al. Workload, recurrence, quality of life and long term efficacy of endoscopic therapy for high-grade dysplasia and intramucosal esophageal adenocarcinoma. Ann Surg 2018; [Epub ahead of print]. [Crossref] [PubMed]
- Sami SS, Ravindran A, Kahn A, et al. Timeline and location of recurrence following successful ablation in Barrett’s oesophagus: an international multicenter study. Gut 2019;68:1379-85. [Crossref] [PubMed]
- Sawas T, Alsawas M, Bazerbachi F, et al. Persistent intestinal metaplasia after endoscopic eradication therapy of neoplastic Barrett's esophagus increases the risk of dysplasia recurrence: meta-analysis. Gastrointest Endosc 2019;89:913-925.e6. [Crossref] [PubMed]
- Manner H, Rabenstein T, Pech O, et al. Ablation of residual Barrett’s epthelium after endoscopic resection: a randomized long-term follow-up study of argon plasma coagulation vs. surveillance (APE study). Endoscopy 2014;46:6-12. [PubMed]

田雷
重庆医科大学附属第一医院,胸外科/心脏大血管外科。博士,副主任医师,JATS会员,中国医疗保健国际交流促进会肺癌微创诊断与治疗学组委员。在日本千叶大学留学5年,长期从事肺癌分子生物学研究及超声气管镜技术开发。已出版国内首部EBUS-TBNA技术专著,发表SCI论文13篇。(更新时间:2021/8/25)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Worrell SG, Bingmer KE, Ofshteyn A, Towe CW, Perry Y, Linden PA. High-grade dysplasia of the esophagus: when is it time for surgery? —a systematic review. Ann Esophagus 2020;3:5.